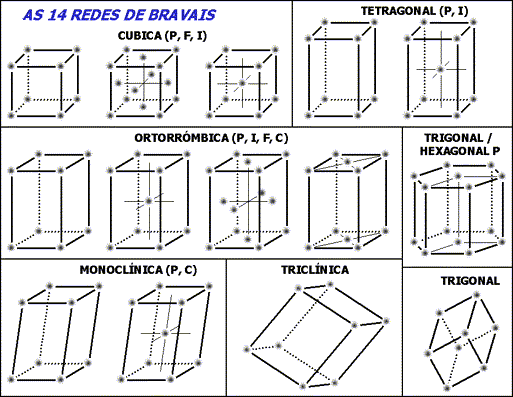
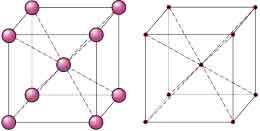
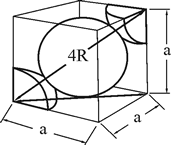
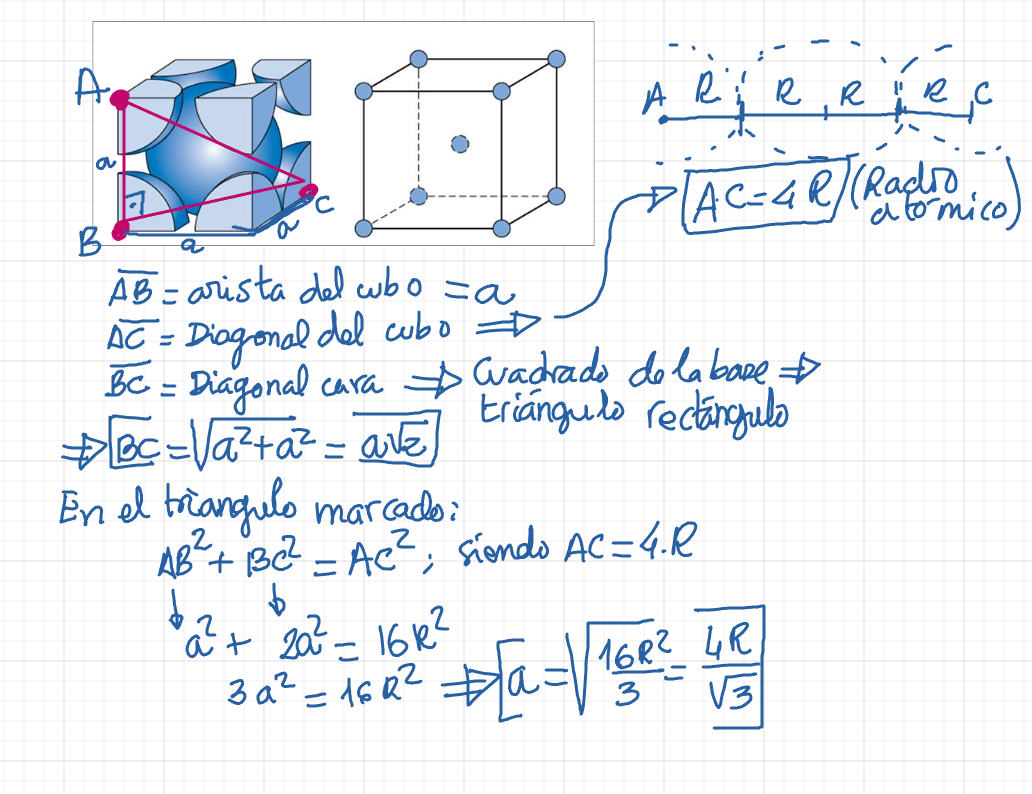
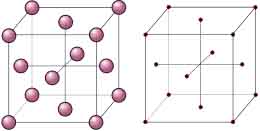
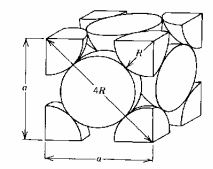
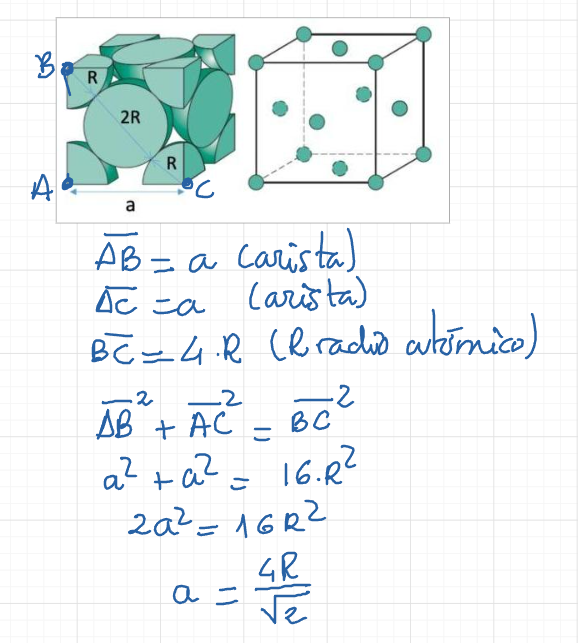
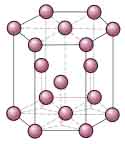
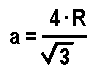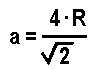Casi todos los materiales metálicos que conocemos a nuestro alrededor tienen una estructura ordenada, es decir, cristalina.
Pero no todas las estructuras son iguales. Podríamos observar distintos metales para establecer una clasificación de las diferentes ordenaciones encontradas, o dicho de una forma más técnica, de las distintas redes encontradas.
También conocemos, en general, los sólidos de la naturaleza son cristalinos. Lo que implica que los iones, átomos o moléculas que los constituyen se ordenan geométricamente en el espacio. En ocasiones esta estructura ordenada no es apreciable a simple vista porque están formados por una agrupación de microcristales orientados de formas diversas dando lugar a estructuras policristalinas, aparentemente amorfas.