3. Composición de la materia: Estructuras cristalinas
- Red cúbica centrada en el cuerpo (BCC)
- Red cúbica centrada en las caras (FCC)
- Red hexagonal compacta (HC)
Importante
Los átomos conforman una estructura con forma de cubo y en ella un átomo ocupa el centro geométrico del cubo y otros ocupan cada uno de los ocho vértices.
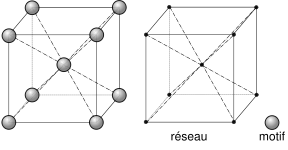
|
| Imagen 33. Wikimedia.Creative Commons |
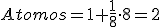
Metales que cristalizan en este sistema son, por ejemplo, hierro α, cromo, titanio, molibdeno, tungsteno, niobio, vanadio, cromo, circonio, talio, sodio y potasio.
Todos ellos tienen como característica común el ser muy resistentes a la deformación.Importante
Red cúbica centrada en las caras, FCC. (Face Centered Cube)
En éstas un átomo ocupa el centro de cada una de las seis caras y otro ocupa cada uno de los ocho vértices.
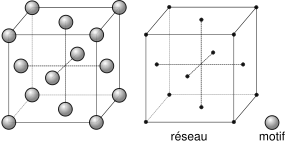 |
| Imagen 34. Wikimedia. Creative Commons. |
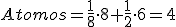
Los metales que cristalizan en esta red son fácilmente deformables.
Ejemplos de metales con estructura FCC son el hierro γ, el cobre, la plata, el platino, el oro, el plomo, el níquel y el aluminio.
Importante
Son aquellas en las que los átomos confoman una estructura con forma de prisma hexagonal, y presentan un átomo en el centro de cada base, un átomo en cada uno de los vértices del prisma y tres átomos más en un plano horizontal, interior al cristal.
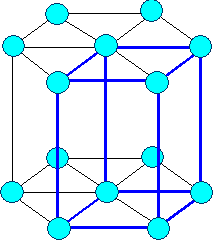
|
| Imagen 35. Wikimedia. Creative Commons |
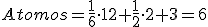
Curiosidad
Cuando ocurre eso decimos que el metal es politrópico, y a cada uno de los sistemas en que cristaliza el metal se le llaman estados alotrópicos.
- A partir de 1539 ºC cristaliza en la red cúbica centrada en el cuerpo (BCC) y a esta variedad alotrópica se le llama Fed
- Al llegar a los 1400 ºC cambia de red de cristalización y cristaliza en la red cúbica centrada en las caras (FCC); a esta variedad alotrópica se le llama Feγ
- A partir de los 900 ºC tenemos el Feβ que cristaliza de nuevo en el BCC
- A los 210 ºC aparece el Feα que, aunque no cambia de red de cristalización, adquiere propiedades magnéticas que seguirá conservando a temperatura ambiente.
Para saber más
En esta página tienes explicada de un forma clara y breve cómo se crea la estructura cristalina de los metales. Tienes además algunas imágenes reales de esta estructura.
http://www2.ing.puc.cl/~icm2312/apuntes/materiales/index.html

